Talidomida
Histórico
A Talidomida, (__-[N-ftalimido]-glutarimida), foi sintetizada no ano de 1954 na Alemanha Ocidental pela German Company Chemie Grünenthal. Os primeiros ensaios clínicos testaram os efeitos espasmolíticos, anestésicos locais e anticonvulsivantes da molécula, entre outros (Lenz, 1988). Entretanto, o que mais se pôde observar foi o efeito de depressão no sistema nervoso central, induzindo sono, e sendo então indicada primeiramente como um agente sedativo (Shardein, 1993). Em 1956 a talidomida foi introduzida no mercado alemão com os nomes comerciais de Contergan® e Grippex® (Lenz, 1988). Na época, foi indicada para o tratamento de diversas condições, tais como irritabilidade, baixa concentração, ansiedade, insônia, enjoos, hipertireoidismo, doenças infecciosas, entre outras indicações (Lenz, 1988; Saldanha, 1994). O grande número de condições que a talidomida podia atuar fez com que esse fármaco fosse considerado uma verdadeira panaceia, inclusive podendo ser adquirido sem a necessidade de prescrição médica (Lenz, 1988; Saldanha, 1994).
Rapidamente, então, a talidomida passou a ser fabricada e vendida em todo o mundo, contendo mais de 40 nomes comerciais e alcançando níveis de vendas extraordinários, chegando a quase 15 toneladas de caixas só no ano de 1961 na Alemanha (Miller & Strömland, 1999).
Nos Estados Unidos (EUA) a talidomida não foi aprovada pela Food and Drug Administration (FDA) devido ao limitado conhecimento sobre seu metabolismo e pelo risco de neuropatia periférica relatado em pacientes tratados por períodos mais longos (Public Affairs Committee, 2000). Os estudos de toxicidade em roedores mostravam que a talidomida era um medicamento de baixo risco de intoxicação e poucos efeitos colaterais. A toxicidade observada era tão baixa que não foi possível determinar a dose letal (LD50) em animais (Shardein, 1993). Além disso, episódios de tentativa de suicídio com o fármaco não obtiveram sucesso, tão pouco produziram sequelas orgânicas (Saldanha, 1994). Todos esses fatos acabavam por reforçar a ideia do medicamento comercializado como “completamente inócuo… seguro… completamente seguro… atóxico e completamente inofensivo” (Oliveira et al., 1999). Entretanto, não se realizou nenhum teste de teratogenicidade, somente de toxicidade, muito embora naquela época já fosse sabido que muitas substâncias químicas, incluindo as de baixa toxicidade aguda em adultos, poderiam causar danos fetais (Lenz, 1988).
O primeiro caso conhecido de uma malformação congênita relacionada ao fármaco foi no final do ano de 1956, na Alemanha, no mesmo local da empresa de fabricação. A criança em questão não tinha orelhas, e a mãe adquiriu amostras de pílulas de talidomida através do seu marido que trabalhava na própria Grünenthal (Shardein, 1993). Mas foi em 1959, inicialmente na Alemanha, que surgiram relatos mais numerosos de recém-nascidos com malformações congênitas (Lenz, 1988). Essas malformações caracterizavam-se por defeitos no desenvolvimento dos ossos longos dos membros, dos quais mãos e pés variavam entre o normal e rudimentar, além de outras malformações associadas (Oliveira et al., 1999). Entretanto, foi somente no final do ano de 1961, com um número cada vez maior de tais anormalidades, que Lenz sugeriu uma possível correlação entre as malformações congênitas e o uso de talidomida durante a gravidez (Lenz, 1961 e b; Lenz, 1962). Paralelamente, na Austrália, McBride também mencionou um aumento de 20% desse tipo de embriopatia, correlacionando-a com o uso do fármaco (McBride, 1961).
Ainda no ano de 1961 a talidomida já não era mais comercializada na Alemanha e Inglaterra, e posteriormente em diversos outros países (Saldanha, 1994). Em agosto de 1962 já era possível observar um grande declínio no número de nascimentos com as malformações de membros (Shardein, 1993). No entanto, milhares de crianças já haviam nascido em todo o mundo com tais anomalias, e o número estimado de vítimas em todo o mundo é em torno de dez a quinze mil crianças nascidas (Matthews & McCoy, 2003; Oliveira et al., 1999). O número de abortos em consequência do uso do fármaco não é conhecido (Matthews & McCoy, 2003).
Como a talidomida não foi liberada nos EUA, o país não registrou muitos casos de embriopatias derivadas desse fármaco. Com isso, os EUA e a FDA saíram fortalecidos dessa situação, e a FDA passou coordenar todas as atividades relativas à política regulatória de medicamentos daquele país (Oliveira et al., 1999). Uma consequência dessa tragédia foi a revolução nas pesquisas com teratologia experimental e o controle na prescrição de novos medicamentos, particularmente para mulheres grávidas (Saldanha, 1994).
Teratogênese e embriopatia por talidomida
Através de dados epidemiológicos, foi possível estabelecer o período da gestação sensível à ação teratogênica da talidomida. A janela teratogênica foi estabelecida entre o 34º ao 50º dia após a última menstruação, ou 20 a 36 dias após a fertilização. (Newman, 1986). Dentro desse período também é possível fazer uma correlação entre os dias de ingestão do fármaco e as malformações observadas (Anexo 1).
Acredita-se que entre 10 e 50% das mulheres que ingerem talidomida durante esse período de sensibilidade têm seus filhos afetados pela embriopatia (Newman, 1986). Isso faz desse fármaco um potente teratógeno para humanos. Pequenas doses de talidomida, como de 50 a 100mg já são capazes de produzir as malformações típicas (Shardein, 1993).
As malformações de membros são as mais descritas dentre todas produzidas pelo efeito teratogênico da talidomida. Os defeitos são normalmente bilaterais, mas não necessariamente simétricos e membros opostos são afetados de forma desigual. É possível dividir os defeitos de membros em quatro grupos (Newman, 1986; Shardein, 1993; Pergament et al., 1997; Berwanger et al., 2001):
- Focomelia (membros curtos ou rudimentares) nos quatro membros;
- Focomelia ou amelia (ausência total) de membros superiores com outros defeitos de membros inferiores;
- Focomelia ou amelia de membros superiores com membros inferiores normais;
- Defeitos de membros inferiores predominantes (hipoplasia femoral ou focomelia de extremidades inferiores), geralmente associados com membros superiores encurvados ou com outros defeitos;
Os membros inferiores e superiores têm deformações pré-axiais e intercalares, sendo as extremidades superiores geralmente acometidas por perda de dígitos e as inferiores por polidactilia e sindactilia (Newman, 1986; Berwanger et al., 2001).
Os defeitos de membros também incluem aplasia do músculo tenar, polegares com três falanges, ausentes ou hipoplásicos, ausência de falanges, hipoplasia do rádio e da ulna, hipoplasia de ombros e quadril, entre outras malformações (Newman, 1986; Shardein, 1993, Taussing, 1962) (Anexo 1).
Os defeitos de membros podem estar associados com anomalias em outros órgãos, e praticamente todos os órgãos do corpo podem ser afetados (Smithells & Newman, 1992). Malformações e/ou perda auditiva são muito comuns, sendo a microtia e anotia as mais frequentes (Newman, 1986). Anormalidades oculares, tais como coloboma, oftalmomegalia, microftalmia, anoftalmia, entre outras são comumente encontradas (Smithells, 1973). Anormalidades neurológicas mais comuns são surdez e paralisia de nervos faciais (Smithells, 1973), porém alguns estudos mostram retardo mental em 6,6% dos indivíduos afetados (Miller & Strömland, 1999). Hemangioma na linha média da face e lábio e/ou palato fendidos são mais frequentemente relatadas em vítimas da talidomida do que na população em geral (Smithells & Newman, 1992).
Dentre as anormalidades de órgãos internos, são frequentes as anormalidades de laringe, traqueia e lobulação dos pulmões (Newman, 1986). Cardiopatia congênita ocorre com considerável frequência e é a principal causa de morte (Smithells, 1973). Dentre as anomalias cardíacas estão os defeitos do septo ventricular, coartação da aorta e Tretralogia de Fallot (Smithells & Newman, 1992).
Algumas estimativas de taxa de mortalidade entre os bebês com as malformações de talidomida estão entre 40 e 45% (Shardein, 1993). As principais causas de morte são anomalias cardíacas, renais e do trato instestinal, e essas são menos comuns entre os sobreviventes devido à severidade (Smithells & Newman, 1992). Em decorrência, a maioria dos recém-nascidos vivos apresentava principalmente malformações de membros, e são, portanto, essas melhores documentadas.
Logo após iniciaram-se as pesquisas a respeito do mecanismo de ação da talidomida. Embora as pesquisas prossigam, nenhuma das hipóteses postuladas até o momento é definitiva, e o mecanismo de ação teratogênico da talidomida ainda não é completamente entendido. As hipóteses mais plausíveis a respeito do mecanismo de ação teratogênica da talidomida podem ser agrupadas em seis categorias (Stephens et al., 2000):
- Replicação ou transcrição do DNA;
- Síntese ou função de fatores de crescimento;
- Síntese ou função de integrinas;
- Angiogênese;
- Condrogênese;
- Injúria ou morte celular.
Resumo para auxílio de diagnóstico
Os efeitos teratogênicos são:
1. DEFEITOS DE MEMBROS SUPERIORES E INFERIORES
São os mais frequentes e se caracterizam como:
- Focomelia (membros curtos ou rudimentares) nos quatro membros;
- Focomelia ou amelia (ausência total) de membros superiores com outros defeitos de membros inferiores;
- Focomelia ou amelia de membros superiores com membros inferiores normais;
- Defeitos de membros inferiores predominantes (hipoplasia femoral ou focomelia de extremidades inferiores), geralmente associados com membros superiores encurvados ou com outros defeitos;
OBSERVAÇÃO: Os defeitos de membros são normalmente bilaterais, mas não necessariamente simétricos e membros opostos são afetados de forma desigual Os membros inferiores e superiores têm deformações pré-axiais e intercalares, sendo as extremidades superiores geralmente acometidas por perda de dígitos e as inferiores por polidactilia (aumento no numero de dedos) e sindactilia (dedos fusionados ou “colados”).
Os defeitos de membros também incluem polegares com três falanges, ausentes ou hipoplásicos, ausência de falanges, hipoplasia do rádio e da ulna, hipoplasia de ombros e quadril, entre outras malformações.
2. ANOMALIAS DE OUTROS ÓRGÃOS
Os defeitos de membros podem estar associados com anomalias em outros órgãos, e praticamente todos os órgãos do corpo podem ser afetados.
- Malformações de orelha e/ou perda auditiva são muito comuns, sendo a microtia (orelha pequena e deformada) e anotia (ausência de orelha) as mais frequentes.
- Anormalidades oculares, tais como microftalmia (olhos pequenos), anoftalmia (ausência de olhos), entre outras são comumente encontradas.
- Anormalidades neurológicas mais comuns são surdez e paralisia de nervos faciais porém alguns estudos mostram retardo mental em 6,7% dos indivíduos afetados.
- Anormalidades da face e lábio e/ou palato fendidos.
- Anormalidades de órgãos internos: são frequentes as anormalidades de laringe, traqueia e lobulação dos pulmões.
- A cardiopatia A cardiopatia congênita (malformação do coração) ocorre com bastante frequência e é a principal causa de morte destas crianças afetadas. Dentre as anomalias cardíacas estão os defeitos do septo ventricular, coartação da aorta e Tretralogia de Fallot (Smithells & Newman, 1992).
- Outros defeitos: anomalias estruturais na vagina e testículos, atresia anal, renais (ausência de rim ou rins malformados e fora do local correto), malformações de bexiga.
Algumas estimativas de taxa de mortalidade entre os bebês com as malformações de talidomida estão entre 40 e 45%. As principais causas de morte são anomalias cardíacas, renais e do trato intestinal, e essas são menos comuns entre os sobreviventes devido à severidade. Em decorrência, a maioria dos recém-nascidos vivos apresentava principalmente malformações de membros, e são, portanto, essas melhores documentadas.
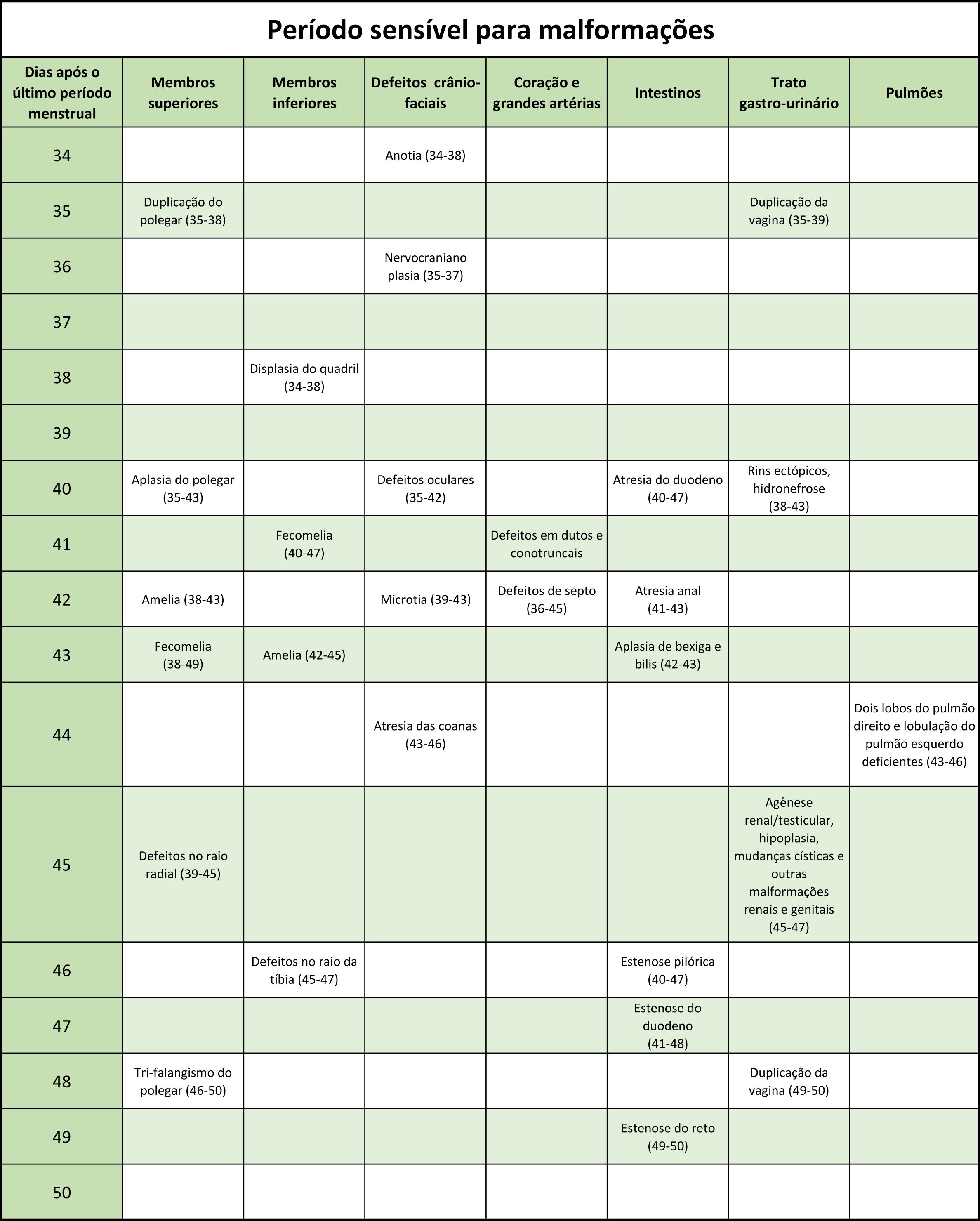
OBSERVAÇÃO 1: a maioria dos defeitos se origina MUITO CEDO durante a embriogênese, no período em que a maioria das mulheres ainda não RECONHECEU a gravidez.
OBSERVAÇÃO 2: após o 50º. dia após a data do início do ultimo período menstrual não há mais risco teratogênico estabelecido.
Segurança
Com a volta da talidomida ao mercado, medidas de controle da dispensação e consumo do fármaco devem ser tomadas para evitar a exposição embrionária nos países onde o medicamento é consumido.
Nos EUA, em 1998, foi implementado um programa para evitar o risco de exposição embrionária, o System for Thalidomide Education and Prescribing Safety (S.T.E.P.S), e programas similares foram implementados internacionalmente pela Pharmion®, que comercializa a talidomida nos EUA, e através de uma licença internacional com a Celgene® na Austrália, Nova Zelândia e Turquia. O STEPS é um programa intensivo que restringe o uso da talidomida somente para médicos, farmacêuticos e pacientes que prescrevam, dispensem e utilizem a talidomida, respectivamente, registrados nesse programa. Os pacientes devem preencher questionários e formulários que garantam o completo entendimento dos riscos eminentes do uso da talidomida. Além disso, qualquer mulher em idade fértil que necessite de tratamento com o fármaco, deve utilizar dois métodos contraceptivos simultaneamente (por quatro semanas antes e durante o tratamento e por quatro semanas após o tratamento, enquanto homens casados com mulheres em idade fértil devem usar preservativo masculino como método de contraceptivo). De qualquer forma, essas mulheres também devem apresentar exames periódicos de gravidez, antes e durante o tratamento, e se caso algum destes testes for positivo, a paciente é retirada imediatamente do programa e encaminhada a um serviço especializado do STEPS (Kathleen et al., 2006).
Outros países que utilizam a talidomida, como o Brasil, Argentina, Portugal, Espanha e França também possuem outros métodos de prevenção de malformações associadas ao uso de talidomida, embora elas não tenham o mesmo desenho, amplitude e adesão do STEPS.
Talidomida no Brasil
A talidomida começou a ser comercializada no Brasil em 1958, e ao longo dos anos em que foi utilizada possuía quatro nomes comerciais: Sedalis®, Sedalis® 100, Sedin® e Slip®. Todos esses fármacos eram indicados nos distúrbios do sono e como tranqüilizantes (Sandanha, 1994; Oliveira et al., 1999).
A partir de 1962, com o reconhecimento da teratogênese, o governo federal cassou as licenças dos fármacos à base de talidomida, mas o ato só foi formalmente estabelecido em 1964, e segundo a Associação Brasileira de Portadores da Síndrome da Talidomida (ABPST), a droga só foi de fato retirada do mercado em 1965 (ABPST, 2008).
Na década de 1960 o uso da talidomida no Brasil foi regulamentado pelo Ministério da Saúde para o tratamento do ENH (Oliveira et al. 1999).
Em 1973, em Porto Alegre, foi Registrada a Associação Brasileira de Vítimas da Talidomida (ABVT), que surgiu com intuito de entrar com ações indenizatórias contra o governo brasileiro (Saldanha, 1994). Em 1976 iniciou-se uma ação judicial contra laboratórios e o governo brasileiro exigindo suas responsabilidades pela tragédia das vítimas da talidomida. A ação arrastou-se por muitos anos, principalmente devido à falta de comprovação do uso da talidomida durante a gravidez das mães de indivíduos afetados. Só em 1982 o governo sancionou a lei 7070 garantindo pensão vitalícia para os portadores de embriopatia por talidomida. Em 1992 foi criada ABPST com o objetivo principal de revisão dos valores das pensões, direito a tratamento cirúrgico, ortopédico e reabilitação (Oliveira et al., 1999).
Concomitantemente à mobilização pelos direitos das vítimas pela ABPST, o Movimento de Reintegração das Pessoas Atingidas pela Hanseníase (Morhan) era notificado do surgimento de uma nova geração de casos de embriopatia por talidomida.
Todos os núcleos do Morhan iniciaram uma investigação de crianças nascidas com defeitos compatíveis com o uso de talidomida, e após uma triagem inicial, 61 casos foram confirmados através de inquéritos mais detalhados, com visitas domiciliares, consulta a laudos médicos e registros dos prontuários das unidades onde ocorreram os tratamentos.
Nas avaliações desses órgãos, dos 61 casos, 4,9% foi entre os anos de 1965-1969, 13,1% nos anos de 1970-1974, 19,7% de 1975-1979, 31,1% de 1980-1984, 23% de 1985-1989 e 13,1% de 1990 a 1994. Na maioria dos casos, 72,7%, o uso da talidomida foi para o tratamento do ENH, sendo que o restante do uso foi sem prescrição e outros motivos não especificados. E o mais alarmante é que o percentual de automedicação, inclusive nos casos de ENH era muito alto, mesmo a talidomida sendo um fármaco de distribuição exclusivamente em serviços de saúde (Oliveira et al., 1999).
Atualmente, a talidomida é fabricada no Brasil pela Fundação Ezequiel Dias, FUNED, em Belo Horizonte, MG, e só pode ser distribuída para o tratamento do ENH, ulcerações aftosas idiopáticas-HIV, lupus eritematoso, REVH e mieloma múltiplo, sendo somente obtido através do Ministério da Saúde e não sob norma comercializada (ANVISA, 2009; FUNED, 2008). Entretanto, há possibilidade de uso para outras indicações, desde que devidamente comprovadas através de ensaios clínicos e documentadas todas as circunstâncias de uso. Esses documentos são enviados, então ao Ministério da Saúde para avaliação e posterior liberação do fármaco (ANVISA, 2008).
Casos de embriopatia por talidomida no Brasil
Os primeiros casos de malformações associadas ao uso de medicamentos à base de talidomida foram relatados em 1960, mas posteriormente foram registrados casos referentes ao ano de 1959. O número de vítimas no Brasil até 1965 é cerca de 300, entretanto, alguns casos foram de difícil comprovação tanto pela elevada ocorrência de automedicação quanto pelo tempo transcorrido da ingestão do fármaco até o diagnóstico (Lenz, 1988; Oliveira et al., 1999; Saldanha, 1994).
Através de 204 registros da ABVT, Schmidt e Salzano avaliaram 93 pacientes com embriopatia por talidomida que nasceram entre os anos de 1959 e 1963. Nesse estudo foi possível estabelecer dados epidemiológicos para tais casos. Observou-se uma maior concentração de nascimentos nos estados do Rio Grande do Sul (RS), Minas Gerais (MG) e São Paulo (SP), respectivamente, e um número maior de nascimentos no ano de 1962 (Schmidt & Salzano, 1983).
Apesar das manifestações do Morhan e ABPST de casos ocorrendo nas décadas de 1970-1990, as únicas manifestações que alcançaram a literatura científica foram a de Gollop e Eigier, em 1987, e Castilla e cols. em 1996. Gollop e Eigier diagnosticaram, pela primeira vez pré-natalmente um caso de embriopatia por talidomida de um feto cuja mãe estava em tratamento para ENH, com doses diárias de 100 mg ingeridas até o 35 dias de gestação. A gestação foi interrompida por decisão dos pais, pois o feto apresentava focomelia dos quatro membros (Gollop & Eigier, 1987).
Castilla e cols. relataram 34 casos de embriopatia por talidomida na América do Sul entre os anos de 1969 a 1995, baseados em informações de maternidades hospitalares que participavam do Estudo Colaborativo Latino Americano de Malformações Congênitas (ECLAMC). Desses, 33 casos são brasileiros, sendo um de 1969, seis da década de 1970, 20 da década de 1980 e seis da década de 1990. Esses casos ocorreram em nove estados brasileiros, sendo a região Sudeste a região com a maior freqüência de embriopatias. Os autores atribuíram o fato da alta incidência de uma segunda geração de vítimas à elevada prevalência de hanseníase no Brasil, e às medidas de controle do fármaco não serem tão severas (Castilla et al., 1996).
Apesar das restrições impostas ao uso de talidomida após o escândalo internacional do surgimento de vítimas nas décadas de 1970-1990 no Brasil e do aparente controle e vigilância de embriopatia por talidomida, nos anos de 2005 e 2006 ainda observou-se a ocorrência de novos casos de embriopatia por talidomida. Esses casos chegaram ao conhecimento do Serviço de Informações sobre Agentes Teratogênicos (SIAT) de Porto Alegre, de forma totalmente casual, sem qualquer notificação ou registro por partes das autoridades em saúde competentes ou serviços de vigilância do fármaco (Schüler-Faccini et al., 2007).
Esses três casos ocorreram nos estados do Maranhão (MA), Rondônia (RO) e Rio Grande do Sul (RS), e a indicação do uso da talidomida era para tratamento do ENH (dois casos), e mieloma múltiplo. Em dois casos, as mães dos bebês malformados não estavam em tratamento com talidomida e utilizaram por conta própria através de um parente próximo, um hábito muito comum em nossa população (Schüler-Faccini et al., 2007).
Além da situação alarmante de compartilhamento de um medicamento que deve ter orientações expressas de uso exclusivo, outra preocupação é que uma das mães das vítimas estava em tratamento para ENH, e relatou não ter assinado o termo de consentimento informado. Além disso, nesse mesmo caso, as condições de dispensação do fármaco não estavam de acordo a Lei 10.651 (Schüler-Faccini et al., 2007).
O surgimento de novas vítimas da embriopatia por talidomida relatada nos anos recentes indica a possibilidade da existência de muitos outros casos não diagnosticados.
Teratogênese: Defeitos de Redução de Membros
A partir da tragédia da talidomida, os defeitos de redução de membros (DRM) passaram a ser considerados particularmente sensíveis a agentes teratogênicos (Castilla et al., 1995). Exemplos disso são o misoprostol, um análogo da prostaglandina E associado com agenesia de dígitos; antagonistas do ácido fólico, que atuam não só aumentando a ocorrência de defeitos de tubo neural, mas também de DRM; síndrome alcoólica fetal, que ocasionalmente provoca esse tipo de defeito, entre outros (McGuirke et al., 2001; Saldanha, 1994);
Além de serem considerados indicadores de agentes teratogênicos, os DRM estão associados a outras anomalias congênitas de 12 a 33% dos casos. Dentre essas associações cita-se anormalidades cromossômicas, como trissomia do cromossomo 13 e do 18, síndromes de herança monogênica, tais como Síndrome de Roberts e Síndrome de Holt-Oram, e também fazem parte de um espectro de malformações clinicamente reconhecíveis, como associação de VATER e defeitos pré-axiais, DRM transversos e hipogênese oromandibular, e hipospádia aliada a DRM pós-axiais (Rosano et al., 2000).
Considerando a hetrogeneidade dos DRM tanto com relação às causas, quanto em relação à extensão do defeito (que vão desde agenesia de uma falange até a ausência de um membro), a necessidade de um sistema de classificação dos DRM é indispensável para a identificação de padrões malformativos que possam sugerir padrões patogenéticos mais homogênenos envolvidos na etiologia dos mesmos (Galán et al., 2000; Rosano et al., 2000). A descrição detalhada e a classificação correta são ferramentas importantes para esses fins. Entretanto, existem divergências entre as classificações, o que resulta na falta de um sistema padronizado para classificação de DRM (Castilla et al., 1995; Stoll et al., 1998; Galãn et al., 2000; EUROCAT, 2004).
Outra ferramenta imprescindível para o conhecimento dos mecanismos envolvidos na produção dessas malformações, é estabelecer a epidemiologia e frequências de base para DRM (Rosano et al., 2000). Essas estimativas também possibilitam a monitorização desses defeitos ao longo dos anos, e através disso pode-se avaliar mudanças nessas frequências, as quais podem evidenciar alterações de estilo de vida da população, ou indicar componentes ambientais que estejam atuando como agentes teratogênicos.
Referências Bibliográficas
Referências Bibliográficas
- ABPST – Associação Brasileira de Portadores da Síndrome da talidomida (2007). http://www.talidomida.org.br. Acesso em 10 de junho de 2008.
- ANVISA – Agência Nacional de Vigilância Sanitária (2008) http://www.anvisa.gov.br/. Acesso em 12 de junho de 2008. Arteaga J, Luna L, Mutchinick OM (2008) Diabetes, pregnancy and birth defects. Rev Invest Clin 60:107-114.
- Azulay RD (2004) Talidomida: indicações em dermatologia. An Bras Dermatol 79:603-608.
Berwanger CG, Costa EC e Peres RM (2001) Talidomida e Ácido Retinóico. In: Sanseverino MTV. - Spritzer DT and Schüler-Faccini L (orgs) Manual de Teratogênese. Editora da UFRGS, pp 275-289.
- Bittencourt R, Almeida AD, Bittencourt HNS, Osten T, Fernandes F, Friederich JR, Fogliato L, Astigarraga CC, Paz A, Silla LMR (2004) Talidomida e mieloma múltipo: verificação dos efeitos terapêuticos através de parâmetros clínico e laboratoriais. Rev Bras Hematol Hemoter 26:245-255.
- Borges LG e Fröehlich PE (2003) Talidomida – Novas Perspectivas para utilização como Antiinflamatório, Imunossupressor e Antiangiogênico. Rev Assoc Med Bras 49:96-102.
- Calabrese L and Fleischer AB (2000) Thalidomide: Current and Potential Clinical Applications. Am J Med 108:487-495.
- Calzolari E, Manservigi D, Garani GP, Cocchi G Magnani C and Milan M (1990) Limb Reduction Defects in Emilia Romagna, Italy: epidemiological and genetic study in 173 109 consecutive births.J Med Genet 27:353-357.
- Castaneda CP, Zeldis JB, Freeman J, Quigley C, Brandenburg NA and Bwire R (2008) RevAssis(®): A Comprehensive Risk Minimization Programme for Preventing Fetal Exposure to Lenalidomide. Drug Saf 31:743-752.
- Castilla EE, Cavalcanti DP, Dutra MG, Lopez-Camelo JS, Paz JE and Gadow EC (1995) Limb Reduction Defects in South America. Br J Obstet Gynaecol 102: 393-400.
- Castilla EE, Ashton-Prolla P, Barreda-Mejia E, Brunoni D, Cavalcanti DP, Correa-Neto J, Degaldillo JL, Dutra MG, Felix T, Giraldo A, Juarez N, Lopez-Camelo JS, Nazer J, Orioli IM, Paz JE, Pessoto MA, Pina-Neto JM, Quadrelli R, Rittler M, Rueda S, Saltos M, Sánchez O, Schüler L (1996) Thalidomide, a Curret Teratogen in South America. Teratology 54:273-277.
- Castilla EE, Lopez-Camelo J and Campaña H (1999) Altitude as a Factor Risk for Congenital Anomalies. Am J Med Genet 86:9-14.
- Castilla EE, Orioli IM, Lopez-Camelo JS, Dutra MG, Nazer-Herrera (2003) Preliminary data on changes in neural tube defect prevalence rates after folic acid fortification in South America. Am J Med Genet A 123:123-128.
- Castilla EE, Orioli IM (2004) ECLAMC: the Latin-American collaborative study of congenital malformations. Community Genet 7:76-94.
- Cavalcanti DP e Salomão MA (2003) Inicdência de hidrocefalia congênita e o papel do diagnóstico pré-natal. J Pediatr 79:135-140.
- Chao NJ, Parker PM, Niland JC, Wong RM, Dagis A, Long GD, Nademanee AP, Negrin RS, Snyder DS, Hu WW, Gould KA, Tierney DK, Zwingenberger K, Forman SJ and Blume KG (1996) Paradoxical effect of thalidomide prophylaxis on chronic graft-versus-host disease. Biol Blood Marrow Transplant 2:86–92.
- Christian MS, Laskin OL, Sharper V, Hoberman A, Stirling DI and Latriano L (2007) Evaluation of the developmental toxicity of lenalidomide in rabbits. Birth Defects Res B Dev Reprod Toxicol 80:188-207.
- D’Amato RJ, Loughnan MS, Flynn E and Folkman J (1994) Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci USA 91:4082-4085.
- Domínguez LPI e Jiménez, JRJ (2006) Síndrome Pseudotalidomídico em el recién nacido de madre diabética. Ver Med Hosp Gen (Mex) 69: 88-91.
- EUROCAT – European Syrveillance of Congenital Anomalies (2004) EUROCAT Guide For the Description and Classification of Congenital Limb Defects.
- http://www.eurocat.ulster.ac.uk/pdf/EUROCAT-Final-Guide-3.pdf Acessado em 04 de março de 2008.
- Filho GRO, Pederneiras SG, Garcia JHS (2001) Uso da Soma Cumulativa dos Desvios para Avaliação da Proficiência no Ensino do Bloqueio Subaracnóideo. Rev Bras Anestesiol 51:208-217.
- FUNED – Fundação Ezequiel Dias (2008) Bula da talidomida. Disponível em:
- http://www.funed.mg.gov.br/produtos_servicos/medicamentos/bulas/pdf/Bula-FUNED%20Talidomida-pdf. Acesso em 10 de junho de 2008.
- Froster-Iskenius UG and Baird PA (1990) Amelia: Incidence and associated defects in a large population. Teratology 41:23-31.
- Froster-Iskenius UG and Baird PA (1993) Maternal Factors, Medications, and Drug Exposure in Congenital Limb Reduction Defects. Environ Health Perspec 101:269-174
- Galán IR, Fernández JT, López EG, bayón CM, Tenreiro CM, Fernández AR, Menéndez ES, Hevia FA e Fernández AF (2000) Defectos de reducción de extremidades em Asturias, 1986-1997: prevalência y presentación clínica. Na Esp Pediatr 52:362-368.
- Geitz H, Handt S and Zwingerberger (1996) Thalidomide selectively modulates the density of the cell surface molecules involved in the adhesion cascade. Immunopharmacology 31:213-221.
- Gershoni-Baruch R, Drugan A, Bronshtein M and Zimmer EZ (1990) Roberts Syndrome or “XLinked Amelia”?. Am J Med Genet 37:569-572.
- Gollop TR and Eigier A (1987) Prenatal Diagnosis of Thalidomide Syndrome. Prenat Diag 7:295-298.
- Haslett PA, Corral LG, Albert M and Kaplan G (1998) Thalidomide Costimulates Primary Human T Lymphocytes, Preferentially Inducing Proliferation, Cytokine Producyion, and Cytotoxic Responses in the CD8+ Subset. J Exp Med 187:1885-1892.
- Hawkins DM and Olwell DH (1998) Cumulative Sum Charts and Charting for Quality Improvement.1st edition. Springer-Verlag, New York, 247pp.
- Hendrix N and Berghella V (2008) Non-placental causes of intrauterine growth restriction. Semin Perinatol 32:161-165.
- ICBDSR (International Clearinghouse for Birth Defects Surveillance and Research) (2006) Annual Report with data for 2004. International Clearinghouse for Birth Defects Surveillance and Research, Roma, 318pp.
- Jacobson JM, Greenspan JS, Spritzler J, Ketter N, Fahey JL, Jackson JB, Fox L, Chernoff M,WuAW, MacPhail LA, Vasquez GJ, and Wohl DA (1997) Thalidomide for the treatment of oral aphthous ulcers in patients with human immunodeficiency virus infection. N Engl J Med 336:1487–1493.
- Jones KL (1997) Smith’s Recognizable Patterns of Human Malformations. 5th ed, WB Saunders Company Philadelphia, Pennsylvania, 857pp.
- Kalil WJF, Odone Filho V, Assis CAM e Kimura HM (1995) Reação Enxerto x Hospedeiro – Forma Crônica com acometimento pulmonar. Pediatria 17: 95-98.
- Källén K (1997) Maternal smoking during pregnancy and limb reduction malformations in Sweden. Am J Public Health 87:29-32.
- Kaplan G, Thomas S, Fierer DS, Mulligan K, Haslett PAJ, Fessel WJ, Smith LG, Kook KA, Stirling D and Schambelan M (2000) Thalidomide for the Treatment of AIDS-Associated Wasting. AIDS Res Hum Retroviruses 16:1345-1355.
- Kathleen UHL, Edward COX, Rogan R, Zeldis JB, Hixon D, Furlong LA, Singer S, Holliman T, Beyer J and Woolever (2006) Thalidomide Use in the US. Drug Safety 29:321-329.
- Keifer JA, Guttridge DC, Ashburner BP and Albert AS (2001) Inhibition of NF-B Activity by Thalidomide through Suppression of IB Kinase Activity. J Biol Chem 276: 22382–22387.
- Kenyon BM, Browne F and D’Amato RJ (1997) Effects of Thalidomide and Related Metabolites in a Mouse Corneal Model of Neovascularization. Exp Eye Res 64:971-978.
- Klausner JD, Freedman VH and Kaplan G (1996) Short Analytical Review: Thalidomide as an Anti-TNF – Inhibitor: Implications for Clinical Use. Clin Immunol Immunopathol 81:219-223.
- Knobloch J, Schimitz I, Götz K, Schulze-Osthoff K and Rüther U (2008) Thalidomide Induces Limb Anomalies by PTEN Stabilization, Akt Suppression, and Stimulation of Caspase-Dependent Cell Death. Mol Cell Biol 28: 529-538.
- Kulldorff M and Nagawalla N (1995) Spatial disease clusters: Detection and Inference. Stat Med 14:799-810.
- Lenz W (1961) Diskussionsbemerkung zu dem Vortrag von R.A. Pfeiffer und K. Kosenow: zur Frage der exogenen Entstehung schwere Extre¨mitatenmissbildungen. Tagung Rheinischwestfal Kinderarztevere Dusseldorf 19:11. Citado a partir de: Miller MT and Strömland K (1999) Teratogen Update: Thalidomide: A Review, With a Focus on Ocular Findings and New Potential Uses.Teratology 60:306-321.
- Lenz W (1961b) Fragen aus der Praxis: kindliche Missbildungen nach Medikament Einnahme wa¨hrend der Graviditat? Dtsch MedWochenschr 86:2555–2556. Citado a partir de: Miller MT and Strömland K (1999) Teratogen Update: Thalidomide: A Review, With a Focus on Ocular Findings and New Potential Uses. Teratology 60:306-321.
- Lenz W (1962) Thalidomide and congenital abnormalities. Lancet 1:271-272. Citado a partir de: Newman CGH (1986) The Thalidomide Syndrome: Risks of Exposure and Spectrum of Malformations. Clin Perinatol 13:555-573.
- Lenz W (1988) A short history of Thalidomide Embryopathy. Teratology 38:203-215.
- Lin S, Marshall EG, Davidson GK, Roth GB and Druschel CH (1993) Evaluation of Congenital Limb Reduction Defects in Upstate New York. Teratology 47:127-135.
- Lucas JM (1985) Couted Data CUSUM’s. Technometrics 27:2
- Mastroiacovo P, Tozzi AE, Agosti S, Bocchino G, Bovicelli L, Dalprà L, Carbone LD, Lituania M, Luttichau A, Mantegazza F, et al.. (1993) Transverse limb reduction defects after chorion villus sampling: a retrospective cohort study. GIDEF–Gruppo Italiano Diagnosi Embrio-Fetali. Prenan Diagn 13:1051-1056.
- Matthews SJ and McCoy C (2003) Thalidomide: A Review of Approved and Investigational Uses. Clin Ther 25:342-395.
- McBride WG (1961) Thalidomide and congenital abnormalities. Lancet 2:1358.
- McGuirke CK, Westgate MN and Holmes LW (2001) Limb Deficiencies in Newborn Infants. Pediatrics 108:E64.
- McIntosh GC, Olshan AF and Baird PA (1995) Paternal age and the risk of birth defects in offspring. Epidemiology 6:282-288.
- Meira MEC, Bittencourt MO e Negreiros RL (2004) Talidomida: Revisão bibliográfica e atualização da bula, conforme Resolução RDC nº 140/03. In: Garcia M, Pepe VLE, Andrade CR e Júnior DMP (Org.) Coleção Escola de Governo – Série Trabalhos de Alunos – Vigilância em Saúde. 1 edição. Escola de Governo em Saúde, Rio de Janeiro, 2004, pp 81-133.
- Melchert M and List A (2007) The thalidomide saga. Int J Biochem Cell Biol 39:1489-1499.
- Michaud J, Filiatrault D, Dallaire L and Lambert M (1995) New Autossomal Recessive Form of Amelia. Am J Med Genet 56:164-167.
- Miller MT and Strömland K (1999) Teratogen Update: Thalidomide: A Review, With a Focus on Ocular Findings and New Potential Uses. Teratology 60:306-321.
- Ministério da Saúde (2008) http://tabnet.datasus.gov.br/cgi/deftohtm.exe?hans/hanswbr.def Acesso em: 13 de junho de 2008.
- Ministério da Saúde (b) (2008) http://portal.saude.gov.br/portal/arquivos/pdf/declaracao_nasc_vivo.pdf Acesso em 25 de junho de 2008.
- Moreira AL, Sampaio EP, Zmuidzinas A, Frindt P, Smith KA and Kaplan G (1993) Thalidomide Exerts Its Inhibitory Action on Tumor Necrosis Factor by Enhancing mRNA Degradation. J Exp Med 177:1675-1680.
- Newman CGH (1986) The Thalidomide Syndrome: Risks of Exposure and Spectrum of Malformations. Clin Perinatol 13:555-573.
- Oliveira MA, Bermudez JAZ e de Souza ACM (1999) Talidomida no Brasil: vigilância com responsabilidade compartilhada? Cad Saude Publica 15:99-112.
- Opromolla DVA (2000) História. In: OPROMOLLA DVA (org) Noções de hansenologia. 1ª edição.Centro de Estudos Dr. Reynaldo Quagliato,São Paulo, pp 1-5.
- Payvandi F, Wu L, Haley M, Schafer PH, Zhang LH, Chen RS, Muller GW and Stirling DI (2004) Immunomodulatory drugs inhibit expression of cyclooxygenase-2 from TNF , IL-1 and LPSestimulated human PBMC in a partially IL-10-dependent manner. Cell Immunol 230:81-88.
- Penna GO, Martelli CMT, Stefani MMA, Macedo VO, Maroja MF and Chaul A (2005) Talidomida no tratamento do eritema nodoso hansênico: revisão sistemática dos ensaios clínicos e perspectivas de novas investigações. An Bras Dermatol 80:511-522.
- Pergament E, Ormond K and Medlin K (1997, December). Thalidomide. RISK Newsletter, 6 (2). http://www.fetal-exposure.org/THALID.php. Acesso em 03 de maio de 2008.
- Poletta FA, Castilla EE, Orioli IM and Lopez-Camelo JS (2007) Regional analysis on the occurrence of oral clefts in South America. Am J Med Genet Part A 143A:3216–3227.
- Public Affairs Committee (2000) Teratology Society Public Affairs Committee Position Paper: Thalidomide. Teratology 62:172-173.
- Rajkumar SV, Blood E, Vesole D, Fonseca R, Greipp PR (2006) Phase III Clinical Trial of Thalidomide Plus Dexamethasome Compared With Dexamethasone Alone in Newly Diagnosed Multiple Myeloma: A Clinical Trial Coordinated by the Eastern Cooperative Oncology Group. J ClinOncol 24:431-436.
- Rosano A, Botto LD, Olney RS, Khoury MJ, Ritvanen A, Goujard J, Stoll C, Cocchi G, Merlob P, Mutchinick O, Cornel MC, Castilla EE, Martinez-Frías ML, Zampino G, Erickson JD and Mastroiacovo P (2000) Limb Defects Associated With Major Congenital Anomalies: Clinical and Epidemiological Study From the International Clearinghouse for Birth Defects Monitoring Systems.Am J Med Genet 93:110-116.
- Rosenak D, Arnon AI, Diamant YZ, Chetrit AB, Nadjari M, Zilberman R, Yaffe H, Cohen T and Ornoy A (1991) Recurrent Tetraamelia and Pulmonary Hypoplasia With Multiple Malformations in Sibs. Am J Med Genet 38:25-28.
- Saldanha PH (1994) A tragédia da Talidomida e o Advento da Teratologia Experimental. Rev. Bras. Genet. 17:449-464.
- Sampaio EP, Sarno EN, Galilly R, Cohn ZA and Kaplan G (1991) Thalidomide Selectively Inhibits Tumor Necrosis Factor Production by Stimuled Human Monocytes. J Exp Med 173:699-703.
- Sapulveda W, Treadwell MC and Fisk NM (1995) Prenatal detection of preaxial upper limb reduction in trisomy 18. Obstet Gynecol 85:847-850.
- Schüler-Faccini L, Leite JCL, Sanseverino MTV e Peres RM (2002) Avaliação de teratógenos na população brasileira. Ciência & Saúde Coletiva 7:65-71.
- Schüler-Faccini L, Soares RCF, Sousa ACM, Maximino C, Luna E, Schwartz IVD, Waldman C, Castilla E (2007) New cases of thalidomide embriopathy in Brazil. Birth Defects Res A 79:671-672.
- Shardein JL (1993) Psychotropic Drugs. In: Shardein JL (ed) Chemically Induced Birth Defects.2nd edition. Marcel Dekker, New York, pp 208-270.
- Singhal S and Mehta J (2002) Thalidomide in cancer. Biomed Pharmacother 56:4-12.
- Schmidt M and Salzano FM (1983) Clinical Studies on Teenage Brazilian Victims of Thalidomide.Braz J Med Biol Res 16:105-109.
- Smithells RW and Newman CGH (1992) Recognition of thalidomide defects. J Med Genet 29: 716-723.
- Stephens TD, Bunde CJW and Fillmore JB (2000) Mechanism of Action in Thalidomide Teratogenesis. Biochem Pharmacol 39:1489-1299.
- Stoll C, Duboule B, Holmes LB and Spanger J (1998) Classification of Limb Reduction Defects Am J Med Genet 77:439-441.
- Teixeira L e Ferreira L (2005). Talidomida: da tragédia ao futuro promissor. http://www.ff.up.pt/toxicologia/monografias/ano0506/talidomida/index.htm. Acesso em 05 de maio de 2008
- Teo SK, Harden JL, Burke AB, Noormohamed FH, Youle M, Johnson MA, Peters BS, Stirling DI and Thomas SD (2001) Thalidomide is distributed into human sêmen after oral dosing. Drug Metab Dipos 29:1355-1357.
- >Teo SK, Colbern WA, Tracewell WG, Kook KA, Stirling DI, Jaworsky MS, Scheffler MA, Thomas SD and Laskin OL (2004) Clinical Pharmacokinetics of Thalidomide. Clin Pharmacokinet 43:311-327.
- Tseng S, Pak G, Washenik K, Pomeranz MK and Shupack JL (1996) Rediscovering thalidomide: a review of its mechanism of action, side effects, and potential uses. J Am Acad Dermatol 35:269-279.
- Yang Q, Khoury MJ, James LM, Olney RS, Paulozzi LJ and Erickson JD (1997) The Return of Thalidomide: Are Birth Defects Surveillance Systems Ready? Am J Med Genet 73:251-258.
- Waller DK, Shaw GM, Rasmussen SA, Hobbs GA, Canfield MA, Siega0Riz AM, Gallaway MS and Correa A (2007) Prepregnancy obesity as a factor risk for structural birth defects. Arch Pediatr Adolesc Med 161:745-750.
- Wu JJ, Huang DB, Pang KR, Hsu S and Tyring SK (2005) Thalidomide: dermatological indications, mechanisms of action and side-effects. Br J Dermatol 153:254-273.
- ABPST – Associação Brasileira de Portadores da Síndrome da talidomida (2007). http://www.talidomida.org.br. Acesso em 10 de junho de 2008.
- ANVISA – Agência Nacional de Vigilância Sanitária (2008) http://www.anvisa.gov.br/. Acesso em 12 de junho de 2008. Arteaga J, Luna L, Mutchinick OM (2008) Diabetes, pregnancy and birth defects. Rev Invest Clin 60:107-114.
- Azulay RD (2004) Talidomida: indicações em dermatologia. An Bras Dermatol 79:603-608.
Berwanger CG, Costa EC e Peres RM (2001) Talidomida e Ácido Retinóico. In: Sanseverino MTV. - Spritzer DT and Schüler-Faccini L (orgs) Manual de Teratogênese. Editora da UFRGS, pp 275-289.
- Bittencourt R, Almeida AD, Bittencourt HNS, Osten T, Fernandes F, Friederich JR, Fogliato L, Astigarraga CC, Paz A, Silla LMR (2004) Talidomida e mieloma múltipo: verificação dos efeitos terapêuticos através de parâmetros clínico e laboratoriais. Rev Bras Hematol Hemoter 26:245-255.
- Borges LG e Fröehlich PE (2003) Talidomida – Novas Perspectivas para utilização como Antiinflamatório, Imunossupressor e Antiangiogênico. Rev Assoc Med Bras 49:96-102.
- Calabrese L and Fleischer AB (2000) Thalidomide: Current and Potential Clinical Applications. Am J Med 108:487-495.
- Calzolari E, Manservigi D, Garani GP, Cocchi G Magnani C and Milan M (1990) Limb Reduction Defects in Emilia Romagna, Italy: epidemiological and genetic study in 173 109 consecutive births.J Med Genet 27:353-357.
- Castaneda CP, Zeldis JB, Freeman J, Quigley C, Brandenburg NA and Bwire R (2008) RevAssis(®): A Comprehensive Risk Minimization Programme for Preventing Fetal Exposure to Lenalidomide. Drug Saf 31:743-752.
- Castilla EE, Cavalcanti DP, Dutra MG, Lopez-Camelo JS, Paz JE and Gadow EC (1995) Limb Reduction Defects in South America. Br J Obstet Gynaecol 102: 393-400.
- Castilla EE, Ashton-Prolla P, Barreda-Mejia E, Brunoni D, Cavalcanti DP, Correa-Neto J, Degaldillo JL, Dutra MG, Felix T, Giraldo A, Juarez N, Lopez-Camelo JS, Nazer J, Orioli IM, Paz JE, Pessoto MA, Pina-Neto JM, Quadrelli R, Rittler M, Rueda S, Saltos M, Sánchez O, Schüler L (1996) Thalidomide, a Curret Teratogen in South America. Teratology 54:273-277.
- Castilla EE, Lopez-Camelo J and Campaña H (1999) Altitude as a Factor Risk for Congenital Anomalies. Am J Med Genet 86:9-14.
- Castilla EE, Orioli IM, Lopez-Camelo JS, Dutra MG, Nazer-Herrera (2003) Preliminary data on changes in neural tube defect prevalence rates after folic acid fortification in South America. Am J Med Genet A 123:123-128.
- Castilla EE, Orioli IM (2004) ECLAMC: the Latin-American collaborative study of congenital malformations. Community Genet 7:76-94.
- Cavalcanti DP e Salomão MA (2003) Inicdência de hidrocefalia congênita e o papel do diagnóstico pré-natal. J Pediatr 79:135-140.
- Chao NJ, Parker PM, Niland JC, Wong RM, Dagis A, Long GD, Nademanee AP, Negrin RS, Snyder DS, Hu WW, Gould KA, Tierney DK, Zwingenberger K, Forman SJ and Blume KG (1996) Paradoxical effect of thalidomide prophylaxis on chronic graft-versus-host disease. Biol Blood Marrow Transplant 2:86–92.
- Christian MS, Laskin OL, Sharper V, Hoberman A, Stirling DI and Latriano L (2007) Evaluation of the developmental toxicity of lenalidomide in rabbits. Birth Defects Res B Dev Reprod Toxicol 80:188-207.
- D’Amato RJ, Loughnan MS, Flynn E and Folkman J (1994) Thalidomide is an inhibitor of angiogenesis. Proc Natl Acad Sci USA 91:4082-4085.
- Domínguez LPI e Jiménez, JRJ (2006) Síndrome Pseudotalidomídico em el recién nacido de madre diabética. Ver Med Hosp Gen (Mex) 69: 88-91.
- EUROCAT – European Syrveillance of Congenital Anomalies (2004) EUROCAT Guide For the Description and Classification of Congenital Limb Defects.
- http://www.eurocat.ulster.ac.uk/pdf/EUROCAT-Final-Guide-3.pdf Acessado em 04 de março de 2008.
- Filho GRO, Pederneiras SG, Garcia JHS (2001) Uso da Soma Cumulativa dos Desvios para Avaliação da Proficiência no Ensino do Bloqueio Subaracnóideo. Rev Bras Anestesiol 51:208-217.
- FUNED – Fundação Ezequiel Dias (2008) Bula da talidomida. Disponível em:
- http://www.funed.mg.gov.br/produtos_servicos/medicamentos/bulas/pdf/Bula-FUNED%20Talidomida-pdf. Acesso em 10 de junho de 2008.
- Froster-Iskenius UG and Baird PA (1990) Amelia: Incidence and associated defects in a large population. Teratology 41:23-31.
- Froster-Iskenius UG and Baird PA (1993) Maternal Factors, Medications, and Drug Exposure in Congenital Limb Reduction Defects. Environ Health Perspec 101:269-174
- Galán IR, Fernández JT, López EG, bayón CM, Tenreiro CM, Fernández AR, Menéndez ES, Hevia FA e Fernández AF (2000) Defectos de reducción de extremidades em Asturias, 1986-1997: prevalência y presentación clínica. Na Esp Pediatr 52:362-368.
- Geitz H, Handt S and Zwingerberger (1996) Thalidomide selectively modulates the density of the cell surface molecules involved in the adhesion cascade. Immunopharmacology 31:213-221.
- Gershoni-Baruch R, Drugan A, Bronshtein M and Zimmer EZ (1990) Roberts Syndrome or “XLinked Amelia”?. Am J Med Genet 37:569-572.
- Gollop TR and Eigier A (1987) Prenatal Diagnosis of Thalidomide Syndrome. Prenat Diag 7:295-298.
- Haslett PA, Corral LG, Albert M and Kaplan G (1998) Thalidomide Costimulates Primary Human T Lymphocytes, Preferentially Inducing Proliferation, Cytokine Producyion, and Cytotoxic Responses in the CD8+ Subset. J Exp Med 187:1885-1892.
- Hawkins DM and Olwell DH (1998) Cumulative Sum Charts and Charting for Quality Improvement.1st edition. Springer-Verlag, New York, 247pp.
- Hendrix N and Berghella V (2008) Non-placental causes of intrauterine growth restriction. Semin Perinatol 32:161-165.
- ICBDSR (International Clearinghouse for Birth Defects Surveillance and Research) (2006) Annual Report with data for 2004. International Clearinghouse for Birth Defects Surveillance and Research, Roma, 318pp.
- Jacobson JM, Greenspan JS, Spritzler J, Ketter N, Fahey JL, Jackson JB, Fox L, Chernoff M,WuAW, MacPhail LA, Vasquez GJ, and Wohl DA (1997) Thalidomide for the treatment of oral aphthous ulcers in patients with human immunodeficiency virus infection. N Engl J Med 336:1487–1493.
- Jones KL (1997) Smith’s Recognizable Patterns of Human Malformations. 5th ed, WB Saunders Company Philadelphia, Pennsylvania, 857pp.
- Kalil WJF, Odone Filho V, Assis CAM e Kimura HM (1995) Reação Enxerto x Hospedeiro – Forma Crônica com acometimento pulmonar. Pediatria 17: 95-98.
- Källén K (1997) Maternal smoking during pregnancy and limb reduction malformations in Sweden. Am J Public Health 87:29-32.
- Kaplan G, Thomas S, Fierer DS, Mulligan K, Haslett PAJ, Fessel WJ, Smith LG, Kook KA, Stirling D and Schambelan M (2000) Thalidomide for the Treatment of AIDS-Associated Wasting. AIDS Res Hum Retroviruses 16:1345-1355.
- Kathleen UHL, Edward COX, Rogan R, Zeldis JB, Hixon D, Furlong LA, Singer S, Holliman T, Beyer J and Woolever (2006) Thalidomide Use in the US. Drug Safety 29:321-329.
- Keifer JA, Guttridge DC, Ashburner BP and Albert AS (2001) Inhibition of NF-B Activity by Thalidomide through Suppression of IB Kinase Activity. J Biol Chem 276: 22382–22387.
- Kenyon BM, Browne F and D’Amato RJ (1997) Effects of Thalidomide and Related Metabolites in a Mouse Corneal Model of Neovascularization. Exp Eye Res 64:971-978.
- Klausner JD, Freedman VH and Kaplan G (1996) Short Analytical Review: Thalidomide as an Anti-TNF – Inhibitor: Implications for Clinical Use. Clin Immunol Immunopathol 81:219-223.
- Knobloch J, Schimitz I, Götz K, Schulze-Osthoff K and Rüther U (2008) Thalidomide Induces Limb Anomalies by PTEN Stabilization, Akt Suppression, and Stimulation of Caspase-Dependent Cell Death. Mol Cell Biol 28: 529-538.
- Kulldorff M and Nagawalla N (1995) Spatial disease clusters: Detection and Inference. Stat Med 14:799-810.
- Lenz W (1961) Diskussionsbemerkung zu dem Vortrag von R.A. Pfeiffer und K. Kosenow: zur Frage der exogenen Entstehung schwere Extre¨mitatenmissbildungen. Tagung Rheinischwestfal Kinderarztevere Dusseldorf 19:11. Citado a partir de: Miller MT and Strömland K (1999) Teratogen Update: Thalidomide: A Review, With a Focus on Ocular Findings and New Potential Uses.Teratology 60:306-321.
- Lenz W (1961b) Fragen aus der Praxis: kindliche Missbildungen nach Medikament Einnahme wa¨hrend der Graviditat? Dtsch MedWochenschr 86:2555–2556. Citado a partir de: Miller MT and Strömland K (1999) Teratogen Update: Thalidomide: A Review, With a Focus on Ocular Findings and New Potential Uses. Teratology 60:306-321.
- Lenz W (1962) Thalidomide and congenital abnormalities. Lancet 1:271-272. Citado a partir de: Newman CGH (1986) The Thalidomide Syndrome: Risks of Exposure and Spectrum of Malformations. Clin Perinatol 13:555-573.
- Lenz W (1988) A short history of Thalidomide Embryopathy. Teratology 38:203-215.
- Lin S, Marshall EG, Davidson GK, Roth GB and Druschel CH (1993) Evaluation of Congenital Limb Reduction Defects in Upstate New York. Teratology 47:127-135.
- Lucas JM (1985) Couted Data CUSUM’s. Technometrics 27:2
- Mastroiacovo P, Tozzi AE, Agosti S, Bocchino G, Bovicelli L, Dalprà L, Carbone LD, Lituania M, Luttichau A, Mantegazza F, et al.. (1993) Transverse limb reduction defects after chorion villus sampling: a retrospective cohort study. GIDEF–Gruppo Italiano Diagnosi Embrio-Fetali. Prenan Diagn 13:1051-1056.
- Matthews SJ and McCoy C (2003) Thalidomide: A Review of Approved and Investigational Uses. Clin Ther 25:342-395.
- McBride WG (1961) Thalidomide and congenital abnormalities. Lancet 2:1358.
- McGuirke CK, Westgate MN and Holmes LW (2001) Limb Deficiencies in Newborn Infants. Pediatrics 108:E64.
- McIntosh GC, Olshan AF and Baird PA (1995) Paternal age and the risk of birth defects in offspring. Epidemiology 6:282-288.
- Meira MEC, Bittencourt MO e Negreiros RL (2004) Talidomida: Revisão bibliográfica e atualização da bula, conforme Resolução RDC nº 140/03. In: Garcia M, Pepe VLE, Andrade CR e Júnior DMP (Org.) Coleção Escola de Governo – Série Trabalhos de Alunos – Vigilância em Saúde. 1 edição. Escola de Governo em Saúde, Rio de Janeiro, 2004, pp 81-133.
- Melchert M and List A (2007) The thalidomide saga. Int J Biochem Cell Biol 39:1489-1499.
- Michaud J, Filiatrault D, Dallaire L and Lambert M (1995) New Autossomal Recessive Form of Amelia. Am J Med Genet 56:164-167.
- Miller MT and Strömland K (1999) Teratogen Update: Thalidomide: A Review, With a Focus on Ocular Findings and New Potential Uses. Teratology 60:306-321.
- Ministério da Saúde (2008) http://tabnet.datasus.gov.br/cgi/deftohtm.exe?hans/hanswbr.def Acesso em: 13 de junho de 2008.
- Ministério da Saúde (b) (2008) http://portal.saude.gov.br/portal/arquivos/pdf/declaracao_nasc_vivo.pdf Acesso em 25 de junho de 2008.
- Moreira AL, Sampaio EP, Zmuidzinas A, Frindt P, Smith KA and Kaplan G (1993) Thalidomide Exerts Its Inhibitory Action on Tumor Necrosis Factor by Enhancing mRNA Degradation. J Exp Med 177:1675-1680.
- Newman CGH (1986) The Thalidomide Syndrome: Risks of Exposure and Spectrum of Malformations. Clin Perinatol 13:555-573.
- Oliveira MA, Bermudez JAZ e de Souza ACM (1999) Talidomida no Brasil: vigilância com responsabilidade compartilhada? Cad Saude Publica 15:99-112.
- Opromolla DVA (2000) História. In: OPROMOLLA DVA (org) Noções de hansenologia. 1ª edição.Centro de Estudos Dr. Reynaldo Quagliato,São Paulo, pp 1-5.
- Payvandi F, Wu L, Haley M, Schafer PH, Zhang LH, Chen RS, Muller GW and Stirling DI (2004) Immunomodulatory drugs inhibit expression of cyclooxygenase-2 from TNF , IL-1 and LPSestimulated human PBMC in a partially IL-10-dependent manner. Cell Immunol 230:81-88.
- Penna GO, Martelli CMT, Stefani MMA, Macedo VO, Maroja MF and Chaul A (2005) Talidomida no tratamento do eritema nodoso hansênico: revisão sistemática dos ensaios clínicos e perspectivas de novas investigações. An Bras Dermatol 80:511-522.
- Pergament E, Ormond K and Medlin K (1997, December). Thalidomide. RISK Newsletter, 6 (2). http://www.fetal-exposure.org/THALID.php. Acesso em 03 de maio de 2008.
- Poletta FA, Castilla EE, Orioli IM and Lopez-Camelo JS (2007) Regional analysis on the occurrence of oral clefts in South America. Am J Med Genet Part A 143A:3216–3227.
- Public Affairs Committee (2000) Teratology Society Public Affairs Committee Position Paper: Thalidomide. Teratology 62:172-173.
- Rajkumar SV, Blood E, Vesole D, Fonseca R, Greipp PR (2006) Phase III Clinical Trial of Thalidomide Plus Dexamethasome Compared With Dexamethasone Alone in Newly Diagnosed Multiple Myeloma: A Clinical Trial Coordinated by the Eastern Cooperative Oncology Group. J ClinOncol 24:431-436.
- Rosano A, Botto LD, Olney RS, Khoury MJ, Ritvanen A, Goujard J, Stoll C, Cocchi G, Merlob P, Mutchinick O, Cornel MC, Castilla EE, Martinez-Frías ML, Zampino G, Erickson JD and Mastroiacovo P (2000) Limb Defects Associated With Major Congenital Anomalies: Clinical and Epidemiological Study From the International Clearinghouse for Birth Defects Monitoring Systems.Am J Med Genet 93:110-116.
- Rosenak D, Arnon AI, Diamant YZ, Chetrit AB, Nadjari M, Zilberman R, Yaffe H, Cohen T and Ornoy A (1991) Recurrent Tetraamelia and Pulmonary Hypoplasia With Multiple Malformations in Sibs. Am J Med Genet 38:25-28.
- Saldanha PH (1994) A tragédia da Talidomida e o Advento da Teratologia Experimental. Rev. Bras. Genet. 17:449-464.
- Sampaio EP, Sarno EN, Galilly R, Cohn ZA and Kaplan G (1991) Thalidomide Selectively Inhibits Tumor Necrosis Factor Production by Stimuled Human Monocytes. J Exp Med 173:699-703.
- Sapulveda W, Treadwell MC and Fisk NM (1995) Prenatal detection of preaxial upper limb reduction in trisomy 18. Obstet Gynecol 85:847-850.
- Schüler-Faccini L, Leite JCL, Sanseverino MTV e Peres RM (2002) Avaliação de teratógenos na população brasileira. Ciência & Saúde Coletiva 7:65-71.
- Schüler-Faccini L, Soares RCF, Sousa ACM, Maximino C, Luna E, Schwartz IVD, Waldman C, Castilla E (2007) New cases of thalidomide embriopathy in Brazil. Birth Defects Res A 79:671-672.
- Shardein JL (1993) Psychotropic Drugs. In: Shardein JL (ed) Chemically Induced Birth Defects.2nd edition. Marcel Dekker, New York, pp 208-270.
- Singhal S and Mehta J (2002) Thalidomide in cancer. Biomed Pharmacother 56:4-12.
- Schmidt M and Salzano FM (1983) Clinical Studies on Teenage Brazilian Victims of Thalidomide.Braz J Med Biol Res 16:105-109.
- Smithells RW and Newman CGH (1992) Recognition of thalidomide defects. J Med Genet 29: 716-723.
- Stephens TD, Bunde CJW and Fillmore JB (2000) Mechanism of Action in Thalidomide Teratogenesis. Biochem Pharmacol 39:1489-1299.
- Stoll C, Duboule B, Holmes LB and Spanger J (1998) Classification of Limb Reduction Defects Am J Med Genet 77:439-441.
- Teixeira L e Ferreira L (2005). Talidomida: da tragédia ao futuro promissor. http://www.ff.up.pt/toxicologia/monografias/ano0506/talidomida/index.htm. Acesso em 05 de maio de 2008
- Teo SK, Harden JL, Burke AB, Noormohamed FH, Youle M, Johnson MA, Peters BS, Stirling DI and Thomas SD (2001) Thalidomide is distributed into human sêmen after oral dosing. Drug Metab Dipos 29:1355-1357.
- >Teo SK, Colbern WA, Tracewell WG, Kook KA, Stirling DI, Jaworsky MS, Scheffler MA, Thomas SD and Laskin OL (2004) Clinical Pharmacokinetics of Thalidomide. Clin Pharmacokinet 43:311-327.
- Tseng S, Pak G, Washenik K, Pomeranz MK and Shupack JL (1996) Rediscovering thalidomide: a review of its mechanism of action, side effects, and potential uses. J Am Acad Dermatol 35:269-279.
- Yang Q, Khoury MJ, James LM, Olney RS, Paulozzi LJ and Erickson JD (1997) The Return of Thalidomide: Are Birth Defects Surveillance Systems Ready? Am J Med Genet 73:251-258.
- Waller DK, Shaw GM, Rasmussen SA, Hobbs GA, Canfield MA, Siega0Riz AM, Gallaway MS and Correa A (2007) Prepregnancy obesity as a factor risk for structural birth defects. Arch Pediatr Adolesc Med 161:745-750.
- Wu JJ, Huang DB, Pang KR, Hsu S and Tyring SK (2005) Thalidomide: dermatological indications, mechanisms of action and side-effects. Br J Dermatol 153:254-273.
